此外,沒有切割活性的cas9(dCas9)仍然有識別結合靶序列的能力,這一特點也可以被巧妙利用于生物傳感,例如將兩個dCas9分別連接上分離熒光素酶的N端和C端,這兩個dCas9的sgRNA被設計為識別結核分枝桿菌DNA上下游的序列片段。如果目標DNA存在,一對dCas9在目標序列上下游分別結合,熒光素酶得以重組,發出熒光信號用于檢測(圖1B)[9]。Guk等[10]在2017年報道了一種利用dCas9對靶標的高度親和性檢測耐甲氧西林金黃色葡萄球菌mecA基因的方法,給dCas9蛋白連接磁球,當dCas9捕捉結合靶標后,磁性分離出dCas9并用SYBR-GreenⅠ顯色其結合的雙鏈DNA,這種將CRISPR/Cas9與DNA熒光原位雜交聯用的方法簡單快速,并展現出相當好的靈敏度。
2.基于CRISPR/Cas13的感染性疾病核酸檢測平臺:Ⅵ型CRISPR系統包含一個名為Cas13a的“效應器”蛋白,其識別靶標類型是單鏈RNA而非DNA(圖1C)。張鋒團隊利用其附屬切割的特點建立起的第一個檢測平臺稱為SHERLOCK[6]。在這個平臺中,首先對靶標進行重組酶聚合酶擴增(recombinase polymerase amplification, RPA)或逆轉錄重組酶聚合酶擴增(reverse transcription-recombinase polymerase amplification, RT-RPA),然后再進行T7轉錄,靶標被擴增的同時也使得檢測的靶標類型不局限于RNA。他們利用SHERLOCK成功對大腸埃希菌、銅綠假單胞菌、結核分枝桿菌、肺炎克雷伯菌和金黃色葡萄球菌進行了鑒定,并且區分出了肺炎克雷伯菌不同的耐藥基因。基于SHERLOCK的檢測方式檢測耗時在2 h內,并且單次檢測的成本低廉,為核酸檢測開啟了新篇章。在此基礎上,張鋒課題組還開發出了SHERLOCKv2[11],即SHERLOCK的二代版本,將Cas13a與Csm6(一種輔助的CRISPR Ⅲ型核酸酶)聯用,兩者協同作用使得信號得以增強,使檢測靈敏度較一代提高了3.5倍。通過用稀釋的等溫擴增引物進行非飽和反應,從一代的定性檢測變為相對定量檢測。通過應用帶有抗FAM抗體和金納米粒子的紙基傳感器,開發出了便攜式試紙條。此外,通過將篩選出的在附屬切割上有序列偏好的3種Cas13蛋白和1種Cas12a蛋白在一個體系中應用,實現了一個體系同時檢測4種病原體。這4點性能的提升和突破使得SHERLOCK在感染性疾病檢測上變得更加靈敏、實用、便攜和高效,例如在醫療條件相對落后地區,不論是DNA、RNA還是細菌感染導致的肺炎都可以用這種方式進行檢測,還可以進行人類免疫缺陷病毒滴度監測以指導抗病毒治療等。從這些優勢中足以預見這種新型分子診斷平臺在感染性疾病診斷上有著極佳的前景。之后,張鋒團隊又將一種通過加熱和化學還原的方式裂解病毒顆粒和滅活核糖核酸酶的樣本預處理方法(HUDSON)添加到SHERLOCK樣本處理步驟中,使得SHERLOCK可以直接用于從臨床樣本中檢測病毒核酸,而省去提取和純化的樣本預處理步驟[12]。這進一步縮短了樣本周轉時間,簡化了步驟,這對于將CRISPR/Cas用于病原體的實時快速檢驗有非常重要的意義。
3.基于CRISPR/Cas12的感染性疾病核酸檢測平臺:Ⅱ類V-A型Cas12蛋白也被發現具有反式切割活性,但與Cas13不同,Cas12靶向DNA并附屬切割單鏈DNA(圖1D)。利用Cas12首先開發出的平臺包括HOLMES和DETECTR。Li等[5]用HOLMES檢測DNA/RNA病毒,可在1 h內從細胞系或臨床樣本中檢測病毒基因型和人類單核苷酸多態性(single nucleotide polymorphism, SNP),并且靈敏度也可達到阿摩爾級。之后的HOLMESv2利用Cas12b具有很寬的反式切割活性溫度范圍特點,將其與環介導的等溫擴增方式相結合,實現了一個集靶標擴增和信號轉化的“一鍋式”核酸檢測系統,支持定量檢測靶DNA[13]。這是迄今為止用于RNA檢測的最簡單的CRISPR生物傳感平臺。Chen等[14]利用DETECTR快速準確地鑒定了各種亞型的HPV病毒。與SHERLOCK類似的是,HOLMES或是DETECTR都可以通過剪切熒光報告探針實現熒光信號檢測或結合紙基傳感策略實現肉眼可見的試紙條檢測(圖1E)。
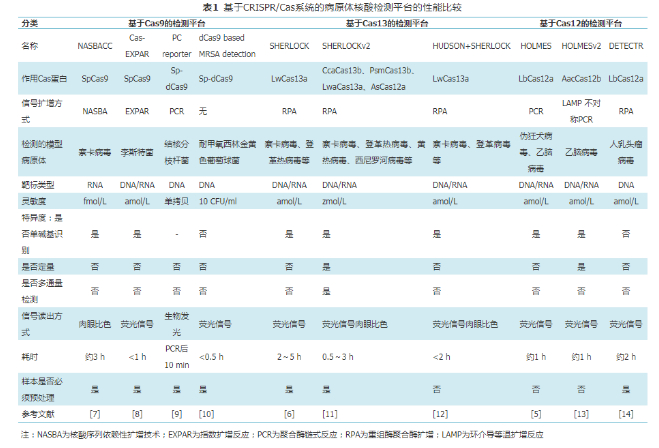
2019年,James課題組提出了一種對傳統材料進行分子編程后用于生物傳感的策略。他們將Cas12a-gRNA復合物嵌入連有單鏈DNA的晶格結構中制成水凝膠[15]。當水凝膠系統暴露于靶標DNA存在的環境中時,Cas12a被激活,其對周圍單鏈DNA的反式切割使得水凝膠的骨架被剪切破壞,從而造成水凝膠的塌陷。在生物傳感方面,用此策略檢測了葡萄球菌的mecA基因片段,激活的Cas12剪切將淬滅熒光基團連接于凝膠骨架的單鏈DNA,導致熒光信號產生。他們還將水凝膠嵌入微流控紙質設備中,開發了一種可以對埃博拉病毒進行實施快速檢測的試紙條,這種試紙條在實戰中表現出相當好的靈敏度和可重復性。新穎的組合方式使得老材料用了新用法,這種創新的思路可以催生更多新穎的生物傳感策略[16]。表1比較了上述具有代表性的基于CRISPR/Cas系統的病原體檢測分子診斷平臺的性能。
三、從新型冠狀病毒肺炎(COVID-19)診斷中看CRISPR/Cas核酸檢測平臺的優勢
2019年底,COVID-19疫情開始在全球范圍內的多個國家暴發,這場疫情也為開發出的基于CRISPR/Cas的分子診斷平臺提供了實戰檢驗的機會。傳統的基于RT-PCR的方法可在4~6 h內檢測病毒,結果相對可靠,然而在面臨傳染性高、突變率高的感染性疾病時,局限性也更加凸顯,其準確性和效率取決于樣本采集部位是否有足夠數量的病毒基因片段,采集的方法不對或者錯過采集的窗口時間可能導致假陰性結果,這在大流行階段是非常可怕的[17]。因此為了提高準確度必須反復檢測,這會大大增加時間及其他附加成本。基于CRISPR/Cas的分子診斷平臺則在一定程度上彌補了這些缺陷。
Chiu課題組將DETECTR開發用于2019-nCoV檢測,將病毒編碼包膜蛋白和核衣殼的基因作為檢測的靶點。整個過程包括:在62 ℃下進行20~30 min的RT-LAMP和在37 ℃下進行10 min的Cas12檢測反應,總用時大約30~40 min,并且是在試紙條上讀取結果。包括RNA提取的整個過程大約45 min,檢測限低至10拷貝數/μl,其準確度則與RT-PCR方法不相上下。更重要的是從病原體發現到開發出這樣成熟的檢測平臺也只需要2周左右[18]。
而張鋒團隊則公布了使用SHERLOCK平臺檢測2019-nCoV的標準流程。他們選用S基因和Orf1ab基因兩種2019-nCoV特異性序列作為檢測靶點,整個檢測過程包括核酸抽提擴增、Cas13反應以及試紙條檢測,耗時在1 h以內,檢測限同樣低至10拷貝數/μl。但考慮到上述方法均需要分兩步,核酸擴增到Cas反應需要轉移樣本,增加了污染概率,張鋒和其他團隊合作又開發出了另一種結合環介導等溫擴增技術和Cas12b的2019-nCoV檢測方式,命名為“STOP”(SHERLOCK testing in one pot)[19]。和HOLMESv2類似,該方法旨在實現等溫擴增步驟和檢測一步反應,減少前處理的步驟,簡化流程,并使得樣本轉移更少,降低污染概率,從而進一步提升檢測的準確度。
總之,上述3個檢測平臺在2019-nCoV的診斷中均表現出了良好的靈敏度和特異度,并且速度更快、操作更方便、適用范圍更廣、單次檢測成本低廉,再次證明CRISPR/Cas核酸檢測平臺在傳染病診斷中的優勢和前景。
四、CRISPR/Cas系統應用于感染性疾病診斷的優勢與局限及未來研究方向
CRISPR/Cas系統毫無疑問為感染性疾病的診斷提供了新的方法和契機,總結來說,它具有如下優點:(1)相較于基于PCR的傳統方法,毫不遜色的靈敏度和特異度。(2)檢測所需時間短。(3)簡單便攜,不依賴昂貴的儀器和嚴苛的實驗環境。(4)試劑耐受冷凍干燥,便于儲存和攜帶。(5)標本前處理可以非常簡單。(6)結果讀取方便,能通過熒光或者肉眼讀取結果。這幾大優點使得CRISPR檢測平臺可以對病原體核酸分子實現實時快速檢測。
但是,CRISPR技術也有一些局限。第一,由于樣本中靶標的低豐度,大多基于CRISPR的檢測方式都需要結合特定的核酸擴增策略,盡管大部分是等溫擴增,相對PCR更加簡單,但這仍然是其向更加便捷、省時方向發展的阻礙。第二,CRISPR技術需要在病原體的基因序列完全清楚的情況下,才能設計gRNA開發出特異的核酸檢測平臺,這一點使得其在不明病原體引起的疾病流行初期能發揮的作用可能很有限。第三,由于CRISPR系統附屬切割活性具有持續性和隨意性,使得此檢測平臺在完全定量檢測、細胞原位檢測的應用上還有待突破。第四,實現類似于SHERLOCKv2一樣更多種病原體的高通量檢測難度較大。第五,脫靶效應的存在可能導致假陰性結果的產生。
因此根據以上幾點也不難推測未來CRISPR技術的兩大研究方向,第一,是新的Cas蛋白的開發及突變體的篩選鑒定。例如后來發現的Cas14蛋白,不同于Cas12和Cas13,其擅長識別單鏈DNA,豐富了CRISPR工具箱[20]。而具有不同切割特性的Cas蛋白的篩選鑒定為提高檢測通量及降低“脫靶效應”提供了方法。第二是將CRISPR/Cas其和其他的技術平臺結合起來,開發新穎實用的生物傳感策略,比如將Cas9蛋白固定于石墨烯場效應晶體管[21],以及將Cas系統的報告探針固定于電極上,從而實現不需要使用信號擴增的電化學生物傳感器的構建[22]。使用水凝膠作為其響應原件實現多樣化的信號輸出[15]。與微流體技術結合開發出的CARMAN技術,可以對數十個樣本,上百種病毒進行快速檢測,為解決通量低的問題提供了方法等[23]。不斷地將新興的材料與技術與CRISPR技術結合實現優勢互補,開發出更實用新穎的生物傳感策略用于感染性疾病診斷將是未來一段時間內的研究重點。
總之,CRISPR/Cas技術作為新興的分子診斷策略,盡管有其局限,但其準確、靈敏、快速、廉價、便攜的特點已經為核酸檢測帶來革命性變化,尤其在感染性疾病的檢驗診斷上有著無可比擬的優勢,未來應用前景極佳。
相關產品:
|
貨號 |
產品 |
規格 |
|
TABAS03KIT |
TwistAmp Basic Kit DNA擴增試劑盒 |
96T |
|
TAEXO02KIT |
TwistAmp exo 試劑盒 |
96T |
|
B8201C1 |
DNA恒溫快速擴增試劑盒(DNA基礎型) |
48T |
|
B8202C3 |
DNA恒溫快速擴增試劑盒(DNA熒光型) |
48T |
|
B8203C5 |
DNA恒溫快速擴增試劑盒(DNA試紙條型) |
48T |
|
B8204C7 |
RNA恒溫快速擴增試劑盒(RNA基礎型) |
48T |
|
B8205C9 |
RNA恒溫快速擴增試劑盒(RNA熒光型) |
48T |
|
B8206C0 |
RNA恒溫快速擴增試劑盒(RNA試紙條型) |
48T |
|
JY0209 |
雙靶標HybriDetect側向層析試紙條(彩虹型) |
50T |
|
JY0201 |
單靶標HybriDetect側向層析試紙條(彩虹型) |
50T |
|
JY0307 |
CRISPR單酶切及擴增產物檢測試紙條 |
50T |
|
JY0301 |
CRISPR Cas12/13 HybriDetect試紙條 |
50T |
|
JY0308 |
CRISPR雙酶切檢測試紙條(變色龍) |
50T |
————公司所有銷售產品僅限科研,不做臨床診斷。


